
提起钻石,你可能会想到光芒耀眼、闪耀耀眼的精巧饰品,以及它昂贵的价格;
提起石墨,你可能会想到黑乎乎、滑腻腻的碳棒。
纯净的金刚石是无色通明、正八面体形状的固体;石墨是一种深灰色有金属光泽而不通明的细鳞片状固体。石墨很软,在纸上画过可留下痕迹,有滑腻感。
金刚石和石墨“形”或“性”有着大相径庭,但它们具有相同的“质”,它们是一对“孪生”兄弟,都由碳元素组成,被称“同素异形体”。

金刚石
金刚石能够用来切开玻璃、做钻头,由于它的硬度很大;石墨能够用来做铅笔芯、润滑剂,这是由于它很软、有滑腻感。依照莫氏硬度规范,金刚石为高级。
金刚石是自然界中天然存在的坚固的物质。金刚石和石墨相同由碳原子构成,金刚石为什么会如此的坚固,这取决于它的分子结构。
下图是金刚石的结构模型。每个碳原子都与周围的4个碳原子经过激烈的相互作用紧密结合。
“紧密结合”的两个碳原子之间的间隔约为0.155nm,然后构成细密的三维结构,正是这种细密的结构,使得金刚石成为天然存在的坚固的物质。
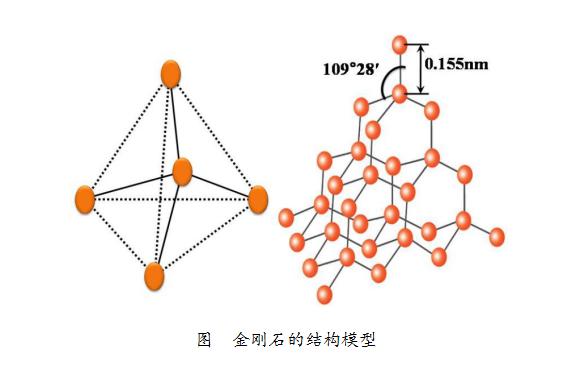 金刚石的结构模型
金刚石的结构模型
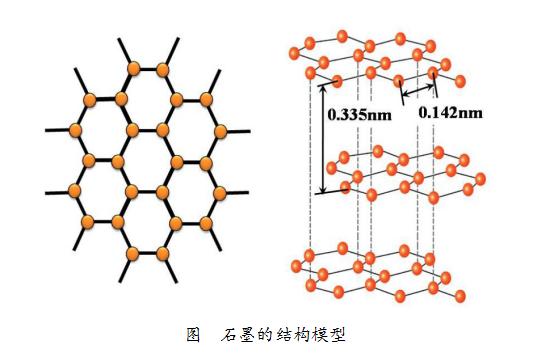
而石墨是层状的结构,就一个片层而言,每1个碳原子会与其周围的3个碳原子经过激烈的相互作用紧密结合,“紧密结合”的两个碳原子之间的间隔约为0.142nm。
 石墨
石墨
在石墨中层与层之间相距为0.335nm,由于间隔比较大,碳原子的相互作用较弱,因而很容易沿着与层面平行的方向滑动、裂解,所以石墨很软、有滑腻感。
金刚石和石墨比较,结构更为细密。金刚石的密度大约是石墨的1.5倍左右(金刚石的密度约为3.5-3.53g/cm³,石墨的密度约为2.09–2.23g/cm³)。
碳原子经过激烈的相互作用(化学键)紧密结合时,原子间的间隔越小,相互作用越强。
在石墨的一个片层中,碳原子间的间隔比金刚石小,相互作用更强,更难被损坏,所以石墨的熔点更高。
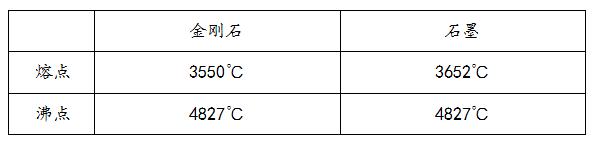
如下表所示,金刚石和石墨的熔点不同,但沸点却相同,这又是为什么呢?物质的物态改变与微粒间的间隔是有必定联系的。
石墨和金刚石熔化今后,碳原子本来的摆放方法被打破,原子间的间隔持平,相互作用强度也相同,所以沸点相同。
咱们都知道,石墨具有导电性。这与石墨的结构也有密切联系。
碳原子外层有4个电子,在石墨的一个片层中,每个碳原子会与其周围的3个碳原子经过“共用电子对”构成激烈的相互作用(化学键),每个碳原子只要3个外层电子参加这种“力”的构成,这样就会剩余1个自由电子。
由于有许多自由电子存在,所以石墨能导电。
而金刚石中每个碳原子与其周围的4个碳原子经过“共用电子对”构成激烈的相互作用,碳原子外层的4个电子简直都参加了这种“力”的构成,基本没有自由电子,所以基本不导电。
结构能够决议性质,金刚石和石墨都由碳原子构成,但是由于原子摆放方法不同,导致许多物理性质有很大差异。
上一篇: 石墨电极,在模具制造电火花加工中的应用
下一篇: 等静压石墨的特性和应用
电话: +86-400-996 1105
传真: +86-375-650 1666
手机: +86 400-996 1105
E-mail: info@xrdgraphite.com
地址: 河南省平顶山市宝丰高新产业集聚区
联系我们